非洲猪瘟新型疫苗研究进展
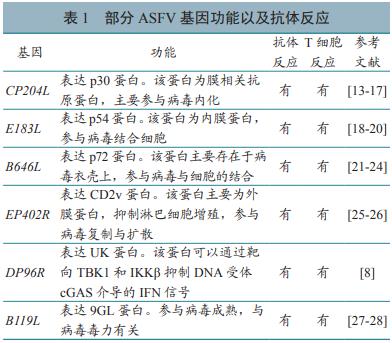
摘要:非洲猪瘟(African swine fever,ASF)已存在约一个世纪,给世界养猪业带来巨大损失和威胁。为此国内外科学家一直致力于ASF疫苗研究,从早期的灭活疫苗、弱毒活疫苗到目前的新型疫苗,包括基因缺失减毒活疫苗、亚单位疫苗、病毒活载体疫苗、DNA疫苗、单周期病毒疫苗等。但直到现在,世界上仍未制造出切实有效并投入生产的ASF疫苗。研究发现:灭活疫苗不具有保护性或仅具有部分保护性;亚单位疫苗具有部分保护性;基因缺失减毒活疫苗被证实具有同源保护性,但其安全问题仍未得到解决;病毒活载体疫苗虽会产生特异性抗体,但仍需要进一步研究;DNA疫苗虽然能够诱导产生体液免疫和细胞免疫,但不能提供保护。目前,一种新型的单周期病毒疫苗正被研究,也为ASF新型疫苗研制提供了新选择。随着基因工程技术与分子生物学技术的不断发展以及对ASF病毒基因组研究的不断深入,ASF疫苗有望研制成功。 非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的急性、热性、高度接触性传染病,主要引起猪发热、呼吸不畅、心跳加速等症状,部分猪会出现咳嗽,眼鼻出现浆液性或黏液性脓性分泌物;外部眼观皮肤发绀,解剖后可发现淋巴结、肾脏、胃黏膜出血明显。由于其高致病性、传染性和死亡率,给世界各国的养猪业带来了严重损失,世界动物卫生组织(OIE)将其列为须通报动物疫病,我国将其列为重点防范的一类动物疫病。 ASF 1921 年首次在肯尼亚被发现,并很长一段时间内局限于撒哈拉以南的非洲国家流行,直到 1957 年后才相继扩散至西欧和拉美国家,但多数疫情被及时消灭。2018年8月,我国出现首例 ASF 疫情。虽然采取了扑杀疫区内全部生猪的控制措施,但 ASF 疫情仍蔓延至全国各地,导致我国生猪产量大幅下降,给我国养猪业带来了巨大影响。ASFV 存活时间长,抵抗力强,基因组强大,易变异 [4],其疫苗研制十分困难,但科研人员仍在不断努力,积极尝试多种疫苗研究。 早期 ASF 疫苗研制主要聚焦于灭活疫苗,但该类疫苗绝大部分无保护作用,其研究十分困难。Blome 等发现, 即使用最新的佐剂( 如PolygenTm 或 Emulsigen®-D)来增强灭活疫苗效果,也起不到有效的免疫保护。弱毒活疫苗免疫原性好,同源保护率高,但具有副作用,安全性差。1963年,西班牙和葡萄牙使用 ASFV 弱毒活疫苗进行了田间试验,发现免疫后的猪均出现肺炎、流产和死亡等不良反应。即使这样,对于 ASFV 弱毒活疫苗的研究也从未间断,但其存在副作用、安全性不高的缺点依然没有得到彻底改善。国内外科学家在ASF传统疫苗研究方面进行了不断尝试和探索,但至今仍然没有商业化的 ASF 疫苗。不过,基因工程技术与分子生物学技术的不断发展,为 ASF疫苗的研制提供了多种新的方向,如基因缺失减毒活疫苗、亚单位疫苗、重组活载体疫苗和 DNA 疫苗等。本文对 ASF 新型疫苗的研制情况进行介绍,以期为 ASF 疫苗的尽快研制成功提供帮助。 1、基因缺失减毒活疫苗 基因缺失减毒活疫苗,是指通过基因工程技术,将病毒的致病基因缺失掉,并在传统减毒活疫苗基础上制成的一种新型疫苗。许多科学家发现了这种基因缺失现象,并利用其提高疫苗的保护效果。Krug 等尝试了多种方法来使 ASFV 毒力减弱,发现 ASFV 在 Vero 细胞中传代后毒力逐渐减少,而且在这些减毒的 ASFV 中均出现了部分基因缺失。Afonso 等报道了 ASFV 的高度保守基因 NL,发现 1 株缺失 NL 基因的欧洲病毒株对家猪完全致弱,而由 2 株高毒力非洲株构建的 NL 缺失突变株对家猪仍保留毒力,但与 NL 基因缺失无关,故认为 ASFV 强毒株不需要 NL 基因功能,单独 NL 基因缺失不足以构建基因缺失减毒活疫苗。Lewis 等研究表明,9GL 基因高度保守,且体外试验发现,9GL 基因编码蛋白影响病毒在巨噬细胞培养物中的成熟和增殖。Carlson 等发现,缺失9GL 基因的毒株为生长缺陷突变株,对家猪高度致弱,用敲除 9GL 基因的毒株免疫后,可对 ASFV野毒株攻毒产生完全保护,这种突变株有望成为ASFV 的候选疫苗株。 然而,不论感染建立与否,评估抗 ASFV 特异抗体、特异 IFN-γ 应答和循环细胞因子水平时,ASFV 的免疫状态都极为复杂。在过去的几年内,人们常通过在体外或非宿主动物中连续传代发展得来的减毒活毒株来研究 ASFV 活疫苗。但随着分子生物学的显著发展,ASFV 基因组功能逐渐清晰,部分 ASFV 基因功能及抗体反应见表 1。这对于研究 ASFV 某个或多个特定基因的缺失变得更加容易,并且为研究特定基因缺失的 ASFV 弱毒苗开辟了新的可能性。Chen 等构建了缺失 7个基因的 HLJ/-18-7GD 疫苗,通过敲除 DP148R、CD2v、9GL、UK 等基因使病毒毒力减弱,并且发现 HLJ/-18-7GD 疫苗在猪骨髓细胞(porcine bone marrow cells,PBMS)中可以保持很好的免疫原性,免疫后进行家猪攻毒试验,发现免疫效果良好,因此或许可以使用初级的 PBMS 大规模生产 HLJ/18-7GD 疫苗。该疫苗有望在以后的 ASF 控制中发挥重要作用。 |
2、亚单位疫苗
亚单位疫苗又称生物合成亚单位疫苗或重组亚单位疫苗,是指将保护性抗原基因在原核或真核细胞中表达,用得到的基因产物蛋白质或多肽制成的疫苗。亚单位疫苗也是最安全的特异性抗原疫苗。ASFV 能编码多达 167 种蛋白,这对筛选候选抗原造成了极大困难。目前,已有多种 ASFV 蛋白被研究,其中 p54、p30、pp220、pp62、p72 和CD2v 被发现参与病毒感染的多个阶段 。用p30 或 p54 蛋白免疫家猪可诱导其产生中和抗体,但并不能阻止免疫家猪的感染死亡,病程也没改变。而用 p30 和 p54 联合免疫家猪,可使其体内产生中和抗体,并可在一定程度上改善病程,因此可以实现部分免疫。Ivanov 等评估了模拟病毒蛋白的 46 种肽,以确定其建立保护免疫应答的能力。Ruiz-Gonzalvo 等 和 Gómez-Puertas 等利用杆状病毒载体表达 CD2v、p54 和 p30 蛋白来免疫猪,发现猪体内产生了中和抗体,并且攻毒后的猪全部存活。但也有研究表明,猪在免疫接种表达的蛋白后可能会出现病毒血症。值得鼓舞的是,目前已有研究证明,亚单位疫苗也能够达到百分百的保护效果,而且安全性很高;研究中选择了 CD2v 基因和杆状病毒载体,证明选择合适的基因及合适的载体研发疫苗是能够获得成功的。
3、病毒活载体疫苗
病毒活载体疫苗是将致病微生物的免疫保护基因,插入到载体病毒或细菌的非必须区,构建成重组病毒,经培养后制备的疫苗。该疫苗不仅具有活疫苗和死疫苗的优点,而且对载体病毒或细菌以及插入基因相关病原体的侵染均有保护作用。Lokhandwala 等 首次将 ASFV 的 p32、p54、pp62 多聚蛋白基因和 p72 基因分别插入腺病毒载体构建表达 Ad-ASFV 多抗原,用 2 种佐剂(ENABL和 Zoetis)的 2 个剂量(1010 和 1011),采取鸡尾酒式免疫猪,结果很快诱导产生了针对 ASFV 抗原的特异性抗体和 CTL 反应。但是,对选择的多抗原疫苗所诱导的免疫反应以及保护效力仍需进一步评估。2016 年 Chen 等 [22] 构建并表达了 ASFVp72 蛋白的重组新城疫病毒,发现重组病毒在鸡胚卵中复制良好,且在免疫小鼠时产生了高滴度的ASFV-p72 特异性的 IgG 抗体,并诱导 T 细胞增殖和分泌 IFN-γ 和 IL-4。但由于 ASFV 的复杂性以及免疫过程的不确定性,针对 ASFV p72 蛋白的疫苗研究仍未得到满意结果。
4、DNA 疫苗
DNA 疫苗又称核酸疫苗或基因疫苗,是指将编码某种蛋白质抗原的重组真核表达载体直接注射到动物体内,使外源基因在活体内得到表达,使产生的抗原激活机体的免疫系统,从而诱导特异性的体液免疫和细胞免疫。在Argilaguet等[32]的试验中,利用编码 ASFV 的 2 个基因质粒免疫猪,却未能检测到免疫应答;在此基础上,研究者重新构建了含有猪白细胞抗原Ⅱ的特异性抗体单链可变片段,再次免疫后,猪产生的免疫应答呈指数提高;但当用致死量的病毒进行攻毒后发现,其并不能提供保护。随后,同组研究者将编码ASFV的血凝素(HA),p30 和 p54 基因插入真核表达载体,以 p30 和 p54的真核表达载体来免疫猪,虽然使猪体内产生了体液免疫与细胞免疫,但同样不能提供保护;研究者进一步将其进行泛素化修饰后免疫发现可提供部分保护 。CD8+ 细胞的高度活化似乎对保护具有重要作用。最近研究表明,将 ASFV 重组蛋白与表达ASFV 基因的 pcDNAs 联合免疫猪,发现在体外可诱导中和抗体的产生,体内可刺激 IFN-γ 的产生,但对强毒攻毒的猪并无保护作用。
5、单周期病毒疫苗
单周期病毒疫苗(Single-cycle virus vaccines)为一种新的安全疫苗。该疫苗缺乏病毒复制所必须的基因。这些存在复制缺陷的病毒在辅助细胞系中扩增,从而表达相应的缺失蛋白。单周期病毒在原位复制缺陷病毒,但并不进行病毒粒子组装。目前,复制缺陷型裂谷热病毒(Rift Valley fevervirus,RVFV)作为单周期病毒疫苗成为新的候选疫苗。该缺陷型 RVFV 在感染的细胞中只能进行单轮复制,而单周期可复制的 RVFV 不会在免疫宿主中引发全身感染,且还可以提供保护性免疫。Crosby 等 构建了一个单周期的腺病毒载体(SC-Ad)。该载体可以复制其基因组和转入基因,但不会引起机体的腺病毒感染。并且试验表明,在小鼠的体内和体外,SC-Ad 和 RC-Ad 在人和小鼠细胞中表达的转入基因比 RD-Ad 高数百倍,因此可以作为更加安全的载体,并且可以被设计用于表达候选抗原。以上讨论的方法同样可以作为一种研究 ASFV 单周期病毒疫苗候选方法。该疫苗的研究不仅需要病毒装配所必需的基因,还需要稳定的细胞系,因此对于 ASFV 单周期病毒疫苗的研究还需更加深入、全面。
6、小结
ASFV 从发现至今约有 1 个世纪。各国科学家对多种疫苗进行了研发尝试,如灭活苗、基因缺失减毒活疫苗、亚单位疫苗、病毒活载体疫苗、DNA 疫苗等。灭活疫苗一般不具有保护性或部分保护性,亚单位疫苗具有部分保护性,而基因缺失减毒活疫苗虽然被证实具有同源保护性,但其安全问题仍未解决。目前,一种新型的单周期病毒疫苗有望在 ASFV 上尝试。今后,仍然需要对 ASFV的基因组进行不断深入研究,从而为 ASFV 疫苗的成功研制打下基础。


